Humant beta-amyloid (1-42)-protein, även känt som Aβ 1-42, är en nyckelfaktor för att låsa upp mysterierna kring Alzheimers sjukdom.Denna peptid spelar en central roll i bildandet av amyloida plack, gåtfulla kluster som skadar hjärnan hos Alzheimers patienter.Med en destruktiv effekt stör den neuronal kommunikation, utlöser inflammation och inducerar neurotoxicitet, vilket leder till kognitiv försämring och neurala skador.Att undersöka dess aggregerings- och toxicitetsmekanismer är inte bara avgörande;det är en spännande resa mot att lösa Alzheimers pussel och utveckla framtida terapier.



Aβ 1-42 är ett peptidfragment på 42 aminosyror som härrör från klyvningen av amyloidprekursorproteinet (APP) av β- och y-sekretaser.Aβ 1-42 är en av huvudkomponenterna i de amyloida plack som ackumuleras i hjärnan hos patienter med Alzheimers sjukdom, en neurodegenerativ störning som kännetecknas av kognitiv försämring och minnesförlust.Aβ 1-42 har visat sig ha olika funktioner och tillämpningar inom biologisk och biomedicinsk forskning, såsom:
1. Neurotoxicitet: Aβ 1-42 kan bilda lösliga oligomerer som har förmåga att binda till och störa funktionen hos neuronala membran, receptorer och synapser.Dessa oligomerer kan också inducera oxidativ stress, inflammation och apoptos i neuroner, vilket leder till synaptisk förlust och neuronal död.Aβ 1-42-oligomerer anses vara mer neurotoxiska än andra former av Aβ, såsom Aβ 1-40, som är den vanligaste formen av Aβ i hjärnan.Aβ 1-42-oligomerer tros också kunna föröka sig från cell till cell, liknande prioner, och utlösa felveckning och aggregering av andra proteiner, såsom tau, som bildar neurofibrillära trassel vid Alzheimers sjukdom.
Aβ 1-42 anses allmänt vara den Ap-isoform med högst neurotoxicitet.Flera experimentella studier har visat neurotoxiciteten hos Aβ 1-42 med användning av olika metoder och modeller.Till exempel, Lesné et al.(Brain, 2013) undersökte bildandet och toxiciteten av Aβ-oligomerer, som är lösliga aggregat av Aβ-monomerer, och visade att Aβ 1-42-oligomerer hade en starkare skadlig effekt på neuronala synapser, vilket ledde till kognitiv nedgång och neuronal förlust.Lambert et al.(Proceedings of the National Academy of Sciences, 1998) lyfte fram neurotoxiciteten hos Aβ 1-42-oligomerer och fann att de hade en stark toxisk effekt på det centrala nervsystemet, möjligen genom att påverka synapser och neurotransmittorer.Walsh et al.(Nature, 2002) visade den hämmande effekten av Aβ 1-42-oligomerer på hippocampus långtidspotentiering (LTP) in vivo, vilket är en cellulär mekanism som ligger till grund för inlärning och minne.Denna hämning var associerad med minnes- och inlärningsförsämring, vilket betonade effekten av Aβ 1-42-oligomerer på synaptisk plasticitet.Shankar et al.(Nature Medicine, 2008) isolerade Aβ 1-42 dimerer direkt från Alzheimers hjärnor och visade deras effekt på synaptisk plasticitet och minne, vilket gav empiriska bevis för neurotoxiciteten hos Aβ 1-42 oligomerer.
Dessutom har Su et al.(Molecular & Cellular Toxicology, 2019) utförde transkriptomik och proteomikanalys av Aβ 1-42-inducerad neurotoxicitet i SH-SY5Y neuroblastomceller.De identifierade flera gener och proteiner som påverkades av Aβ 1-42 i vägar relaterade till apoptotisk process, proteintranslation, cAMP katabolisk process och svar på endoplasmatisk retikulumstress.Takeda et al.(Biological Trace Element Research, 2020) undersökte rollen av extracellulär Zn2+ i Aβ 1-42-inducerad neurotoxicitet vid Alzheimers sjukdom.De visade att Aβ 1-42-inducerad intracellulär Zn2+ toxicitet accelererades med åldrandet på grund av åldersrelaterad ökning av extracellulär Zn2+.De föreslog att Aβ 1-42 utsöndras kontinuerligt från neuronterminaler orsakar åldersrelaterad kognitiv nedgång och neurodegeneration via intracellulär Zn2+ dysreglering.Dessa studier tyder på att Aβ 1-42 är en nyckelfaktor för att mediera neurotoxicitet och sjukdomsprogression vid Alzheimers sjukdom genom att påverka olika molekylära och cellulära processer i hjärnan.
2. Antimikrobiell aktivitet: Aβ 1-42 har rapporterats ha antimikrobiell aktivitet mot olika patogener, såsom bakterier, svampar och virus.Aβ 1-42 kan binda till och störa membranen hos mikrobiella celler, vilket leder till lys och död.Aβ 1-42 kan också aktivera det medfödda immunsystemet och rekrytera inflammatoriska celler till infektionsplatsen.Vissa studier har föreslagit att ackumulering av Aβ i hjärnan kan vara ett skyddande svar på kroniska infektioner eller skador.Emellertid kan överdriven eller oreglerad produktion av Aβ också orsaka kollateral skada på värdcellerna och vävnaderna.
Aβ 1-42 har rapporterats uppvisa antimikrobiell aktivitet mot en rad patogener, såsom bakterier, svampar och virus, såsom Staphylococcus aureus, Escherichia coli, Candida albicans och Herpes simplex virus typ 1, genom att interagera med deras membran och orsakar deras avbrott och lys.Kumar et al.(Journal of Alzheimer's Disease, 2016) visade denna effekt genom att visa att Aβ 1-42 förändrade membranpermeabiliteten och morfologin hos mikrobiella celler, vilket ledde till deras död.Förutom sin direkta antimikrobiella verkan kan Aβ 1-42 också modulera det medfödda immunsvaret och rekrytera inflammatoriska celler till infektionsplatsen.Soscia et al.(PLoS One, 2010) avslöjade denna roll genom att rapportera att Aβ 1-42 stimulerade produktionen av pro-inflammatoriska cytokiner och kemokiner, såsom interleukin-6 (IL-6), tumörnekrosfaktor-alfa (TNF-α), monocyt kemoattraktant protein-1 (MCP-1) och makrofaginflammatoriskt protein-1 alfa (MIP-1α), i mikroglia och astrocyter, de viktigaste immuncellerna i hjärnan.
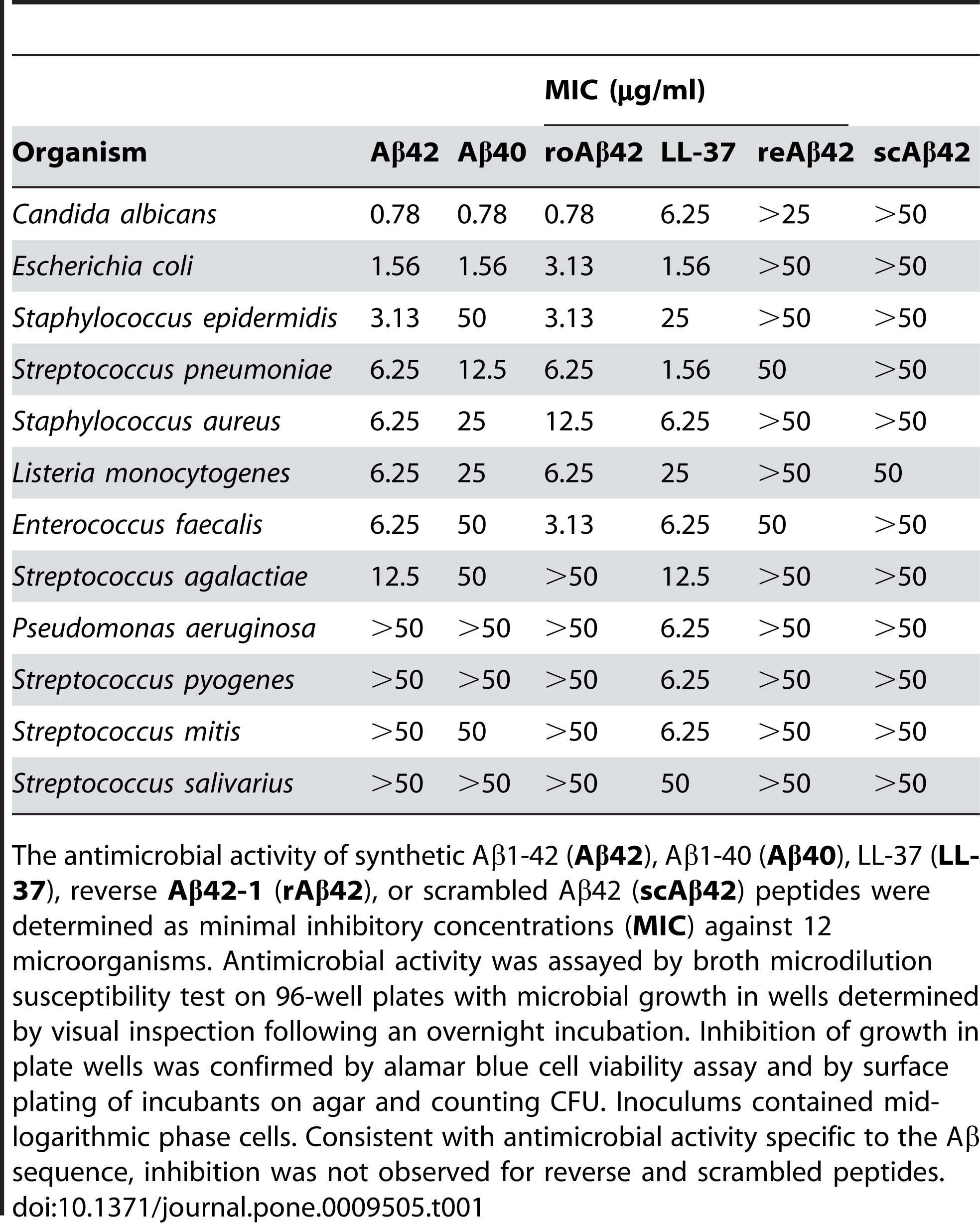
Figur 2. Ap-peptider har antimikrobiell aktivitet.
(Soscia SJ, Kirby JE, Washicosky KJ, Tucker SM, Ingelsson M, Hyman B, Burton MA, Goldstein LE, Duong S, Tanzi RE, Moir RD. Alzheimers sjukdomsassocierade amyloid beta-protein är en antimikrobiell peptid. PLoS One . 3 mars 2010;5(3):e9505.)
Även om vissa studier har föreslagit att ackumulering av Aβ i hjärnan kan vara ett skyddande svar på kroniska infektioner eller skador, eftersom Aβ kan fungera som en antimikrobiell peptid (AMP) och eliminera potentiella patogener, förblir det komplexa samspelet mellan Aβ och mikrobiella element en ämne för undersökning.Den känsliga balansen framhävs av forskningen av Moir et al.(Journal of Alzheimer's Disease, 2018), som antyder att obalanserad eller överdriven Aβ-produktion oavsiktligt kan skada värdceller och vävnader, vilket återspeglar den invecklade dubbla naturen hos Aβs roller i infektion och neurodegeneration.Överdriven eller oreglerad produktion av Aβ kan leda till dess aggregering och avsättning i hjärnan, vilket bildar toxiska oligomerer och fibriller som försämrar neuronal funktion och inducerar neuroinflammation.Dessa patologiska processer är associerade med kognitiv försämring och minnesförlust vid Alzheimers sjukdom, en neurodegenerativ störning som kännetecknas av progressiv demens.Därför är balansen mellan de fördelaktiga och skadliga effekterna av Aβ avgörande för att upprätthålla hjärnans hälsa och förhindra neurodegeneration.
3. Järnexport: Aβ 1-42 har visat sig vara involverad i regleringen av järnhomeostas i hjärnan.Järn är ett väsentligt element för många biologiska processer, men överskott av järn kan också orsaka oxidativ stress och neurodegeneration.Aβ 1-42 kan binda till järn och underlätta dess export från neuroner via ferroportin, en transmembran järntransportör.Detta kan hjälpa till att förhindra järnansamling och toxicitet i hjärnan, eftersom överskott av järn kan orsaka oxidativ stress och neurodegeneration.Duce et al.(Cell, 2010) rapporterade att Aβ 1-42 band till ferroportin och ökade dess uttryck och aktivitet i neuroner, vilket ledde till minskade intracellulära järnnivåer.De visade också att Aβ 1-42 minskade uttrycket av hepcidin, ett hormon som hämmar ferroportin, i astrocyter, vilket ytterligare förbättrade järnexporten från neuroner.Järnbundet Aβ kan emellertid också bli mer benäget att aggregeras och avsättas i det extracellulära utrymmet, vilket bildar amyloida plack.Ayton et al.(Journal of Biological Chemistry, 2015) rapporterade att järn främjade bildningen av Aβ-oligomerer och fibriller in vitro och in vivo.De visade också att järnkelering minskade Aβ-aggregation och avsättning hos transgena möss.Därför är balansen mellan de fördelaktiga och skadliga effekterna av Aβ 1-42 på järnhomeostas avgörande för att upprätthålla hjärnans hälsa och förhindra neurodegeneration.
Vi är en polypeptidtillverkare i Kina, med flera års mogen erfarenhet av polypeptidproduktion.Hangzhou Taijia Biotech Co., Ltd. är en professionell tillverkare av polypeptidråvaror, som kan tillhandahålla tiotusentals polypeptidråvaror och även kan anpassas efter behov.Kvaliteten på polypeptidprodukter är utmärkt, och renheten kan nå 98%, vilket har erkänts av användare över hela världen. Välkommen att rådfråga oss.






