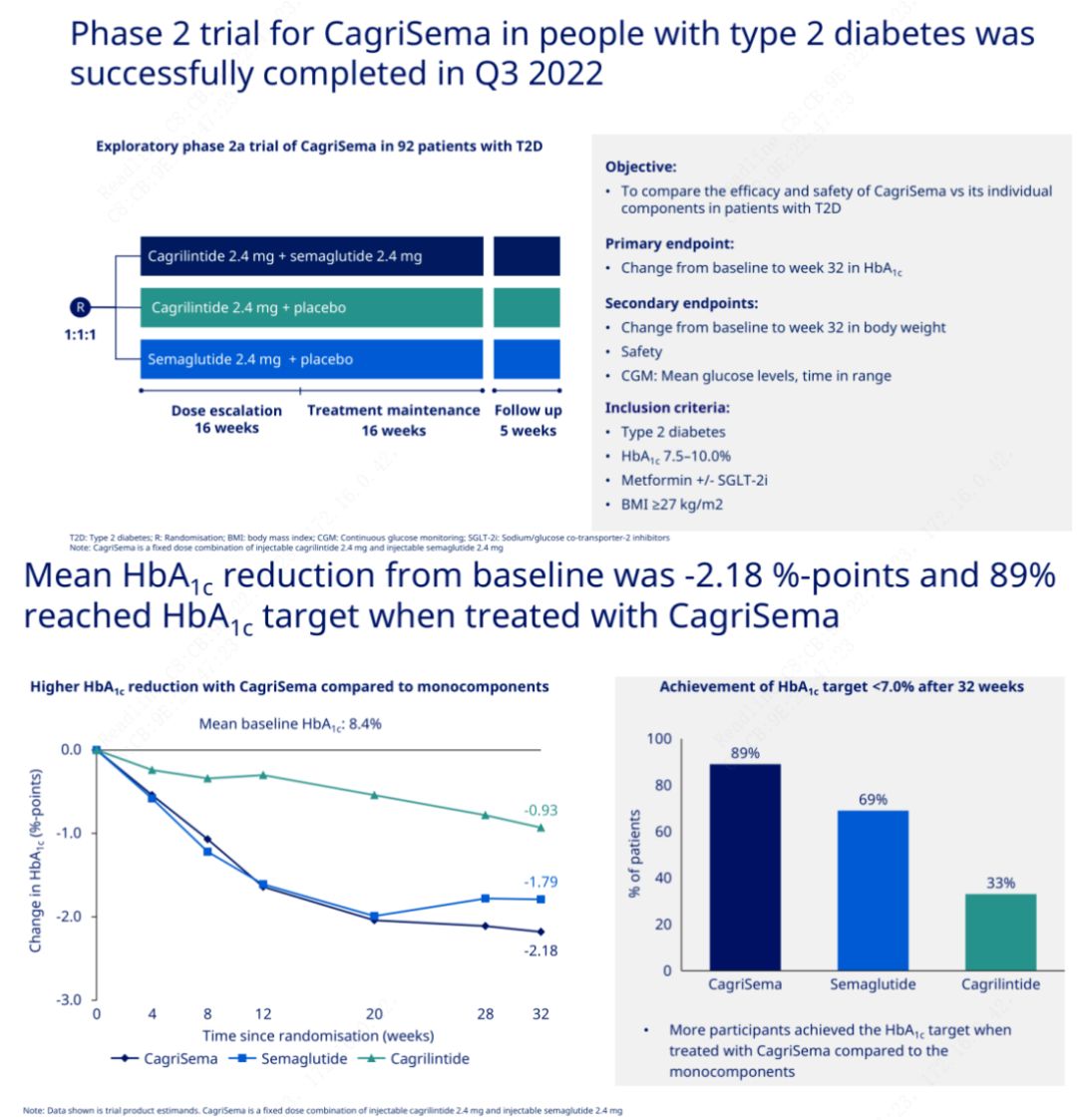
Den 5 juli lanserade Novo Nordisk en klinisk fas III-studie av CagriSema-injektion i Kina, vars syfte är att jämföra säkerheten och effekten av CagriSema-injektion med semeglutid hos feta och överviktiga patienter i Kina.
CagriSema-injektion är en långverkande kombinationsterapi under utveckling av Novo Nordisk, huvudkomponenterna är GLP-1 (glukagonliknande peptid-1) receptoragonist smeglutid och en långverkande amylinanalog cagrilintid.CagriSema-injektion kan administreras subkutant en gång i veckan.
Det primära målet var att jämföra CagriSema (2,4 mg/2,4 mg) med semeglutid eller placebo en gång i veckan subkutant.Novo Nordisk har tillkännagett resultaten av ett försök med CagriSema för behandling av diabetes stadium 2, som visade att CagriSemas hypoglykemiska effekt är bättre än semeglutid, och nästan 90 % av försökspersonerna har uppnått HbA1c-målet.
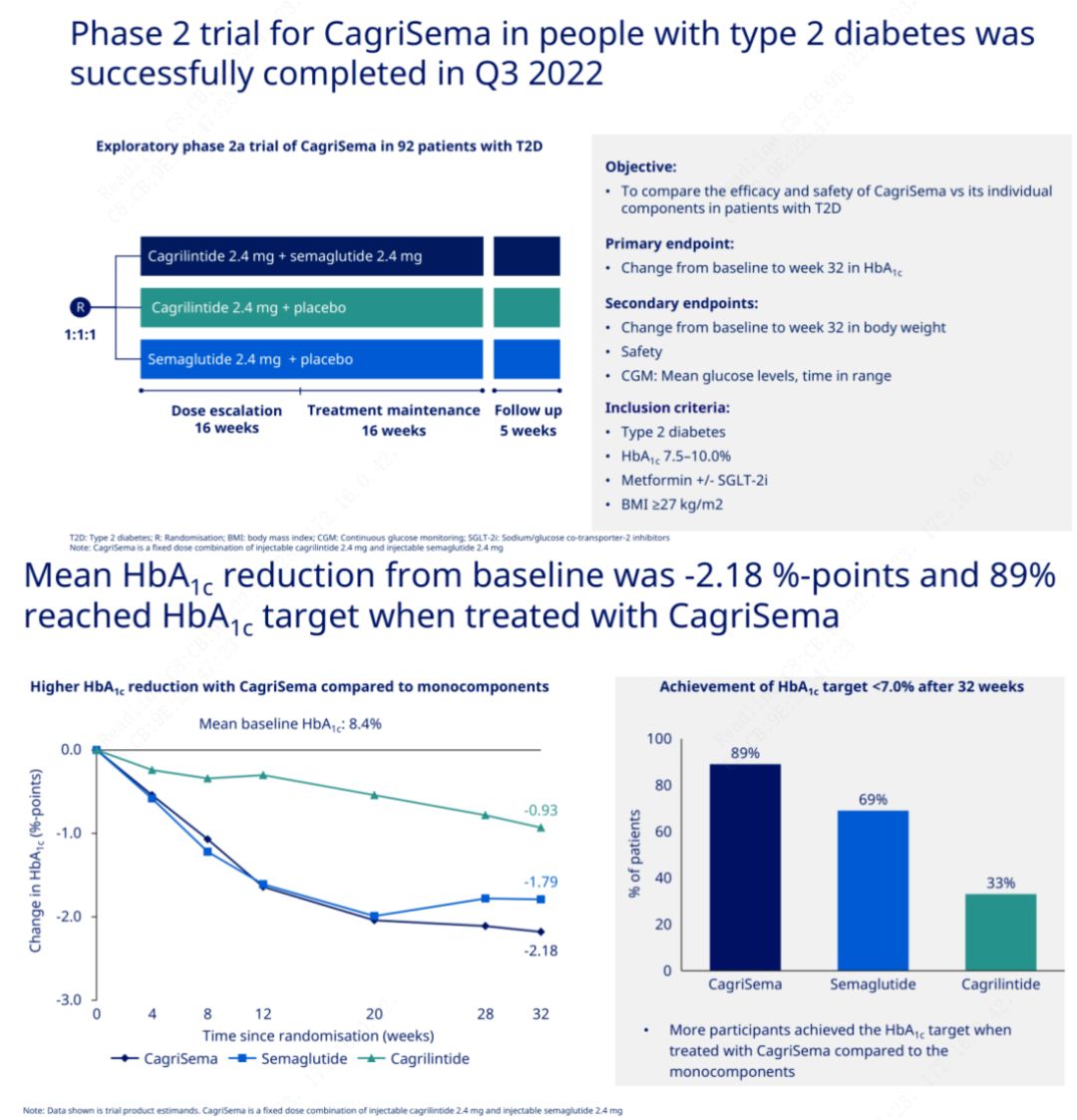
Data visade att förutom den signifikanta hypoglykemiska effekten, när det gäller viktminskning, överträffade CagriSema-injektion signifikant semeglutid (5,1 %) och cagrilintid (8,1 %) med en viktminskning på 15,6 %.
Det innovativa läkemedlet Tirzepatide är världens första godkända veckovisa GIP/GLP-1-receptoragonist.Den kombinerar effekterna av två inkretiner till en enda molekyl som injiceras en gång i veckan och är en ny klass av behandlingar för typ 2-diabetes.Tirzepatide godkändes av US Food and Drug Administration (FDA) i maj 2022 för att förbättra glykemisk kontroll (på kost och träning) hos vuxna med typ 2-diabetes och är för närvarande godkänt i EU, Japan och andra länder.
Den 5 juli tillkännagav Eli Lilly en fas III SURPASS-CN-MONO-studie om registrerings- och informationsplattformen för kliniska läkemedelsprövningar för behandling av typ 2-diabetespatienter.SURPASS-CN-MONO är en randomiserad, dubbelblind, placebokontrollerad fas III-studie utformad för att utvärdera effekten och säkerheten av tirzepatid monoterapi jämfört med placebo hos personer med typ 2-diabetes.Studien planerade att inkludera 200 patienter med typ 2-diabetes som inte tog några antidiabetiska läkemedel under de 90 dagarna före besök 1 (förutom i vissa kliniska situationer, såsom akut sjukdom, sjukhusvistelse eller elektiv kirurgi, kortvarig (≤14) dagar) användning av insulin).
Typ 2-diabetes förväntas godkännas i år
Förra månaden publicerades resultaten från en SURPASS-AP-Combo-studie den 25 maj i storfilmstidskriften Nature Medicine.Resultaten visade att jämfört med insulin glargin visade Tirzepatide bättre HbA1c och viktminskning i populationen av typ 2-diabetespatienter i Asien-Stillahavsområdet (främst Kina): HbA1c-reduktion med upp till 2,49 % och viktminskning med upp till 7,2 kg (9,4 %) vid 40 veckors behandling, signifikant förbättring av blodlipider och blodtryck samt övergripande säkerhet och tolerabilitet var god.
Den kliniska fas 3-prövningen av SURPASS-AP-Combo är Tirzepatides första studie som huvudsakligen genomfördes på kinesiska patienter med typ 2-diabetes, ledd av professor Ji Linong vid Peking University People's Hospital.SURPASS-AP-Combo överensstämmer med resultaten av den globala SURPASS-serien av forskning, som ytterligare bevisar att patofysiologin för diabetes hos kinesiska patienter överensstämmer med den hos globala patienter, vilket är grunden för samtidig forskning och utveckling av nya läkemedel i Kina och världen, och ger också gediget evidensstöd för att ge kinesiska patienter möjlighet att använda de senaste diabetesläkemedlen och deras kliniska tillämpning i Kina så snart som möjligt.
Posttid: 2023-09-18

